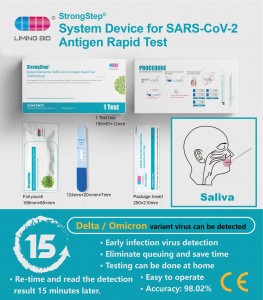
Prueba rápida de antígeno SARS-CoV-2 (Nasal)
El producto tiene un agente exclusivo en Nueva Zelanda. Si está interesado en comprar, la información de contacto es la siguiente:
Mick Dienhoff
Gerente general
Número de teléfono: 0755564763
Número móvil: 0492 009 534
E-mail: enquiries@nzrapidtests.co.nz
Uso previsto
StrongStep® SARS-CoV-2 Antígeno Rapid Test Cassette emplea tecnología de inmunocromatografía para detectar el antígeno nucleocapsido SARS-CoV-2 en la muestra de hisopo nasal anterior humano. Este testículo solo usa solo y está destinado a la autoevaluación. Se recomienda usar esta prueba dentro de los 5 días posteriores al inicio de los síntomas. Está respaldado por la evaluación del desempeño clínico.
INTRODUCCIÓN
Los novedosos coronavirus pertenecen al género Totiie P. Covid-19 es una enfermedad infecciosa respiratoria aguda. Las personas son generalmente susceptibles. Actualmente, los pacientes infectados por el nuevo cxjronavinis son la principal fuente de infección; Las personas infectadas asintomáticas también pueden ser una fuente infecciosa. Basado en la investigación epidemiológica actual, el período de incubación es de 1 a 14 días, principalmente de 3 a 7 días. Las manifestaciones principales incluyen fiebre, fatiga y tos seca. La congestión nasal, la secreción nasal, el dolor de garganta, la mialgia y la diarrea se encuentran en algunos casos.
PRINCIPIO
La prueba de antígeno StrongStep® SARS-CoV-2 emplea una prueba inmunocromatográfica. Los anticuerpos conjugados de látex (látex-AB) correspondientes a SARS-CoV-2 se inmobilan en seco al final de la tira de membrana de nitrocelulosa. Los anticuerpos SARS-CoV-2 son enlaces en la zona de prueba (T) y la biotina-BSA es el enlace en la zona de control (C). Cuando se agrega la muestra, migra por difusión capilar rehidratando el conjugado de látex. Si está presente en la muestra, los antígenos SARS-CoV-2 se unirán con los anticuerpos conjugados que forman partículas. Estas partículas continuarán migrando a lo largo de la tira hasta la zona de prueba (t) donde son capturadas por anticuerpos SARS-CoV-2 que generan una línea roja visible. Si no hay antígenos SARS-CoV-2 en la muestra, no se forma la línea roja en la zona de prueba (t). El conjugado de estreptavidina continuará migrando solo hasta que sea capturado en la zona de control (c) por la biotina-BSA que se agregó en una línea azul, lo que indica la validez de la prueba.
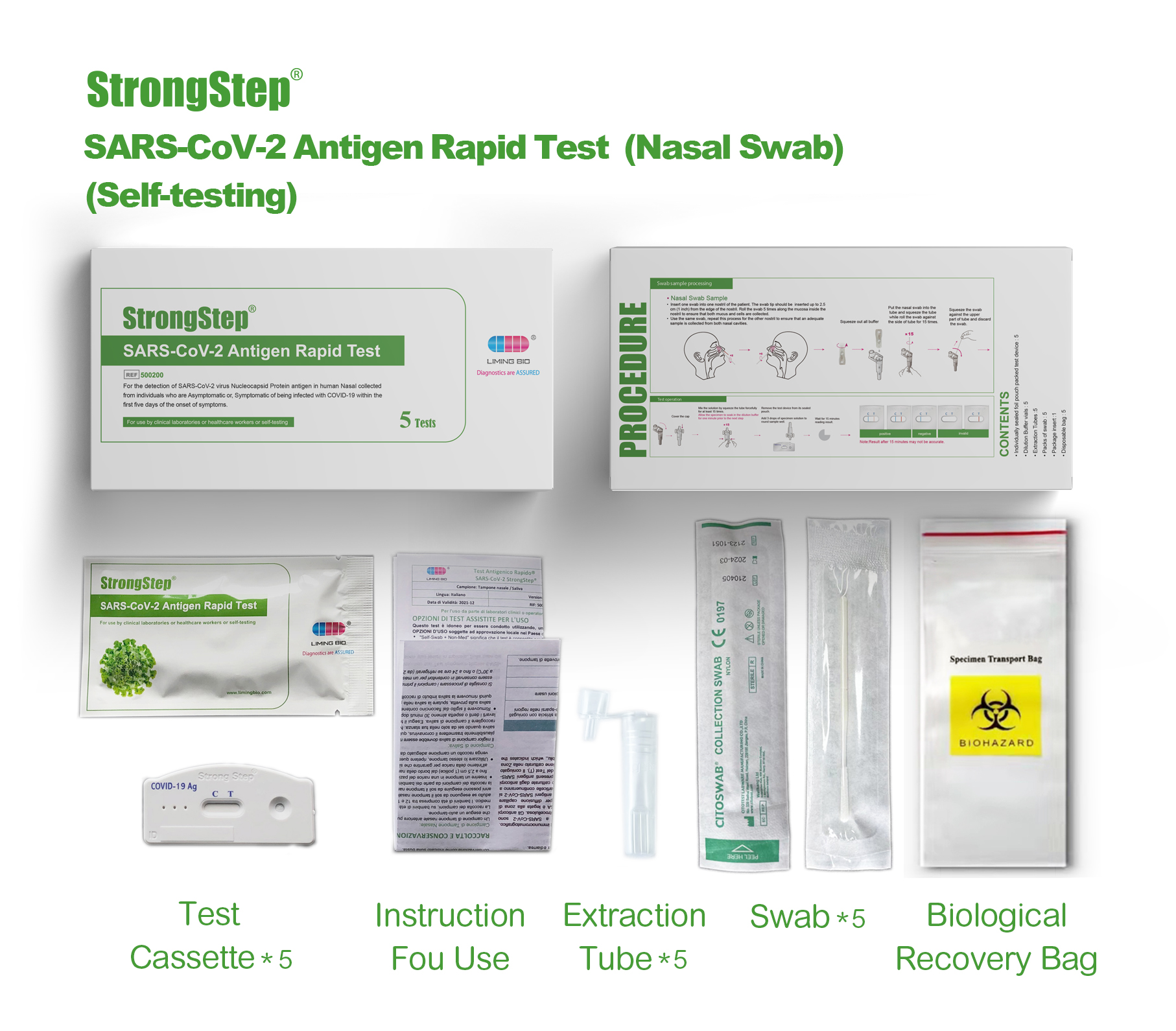
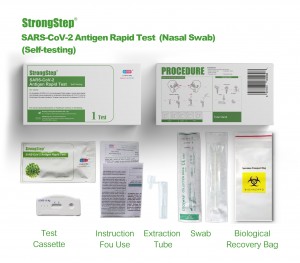
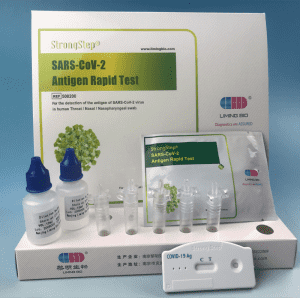
Componentes del kit
1 prueba/caja ; 5 pruebas/caja:
| Dispositivos de prueba empacados de bolsas selladas | Cada dispositivo contiene una tira con conjugados de color y reactivos reactivos previamente en las regiones correspondientes. |
| VIALS DE BONDO DE DILUCIÓN | 0,1 m de solución salina tamponada con fosfato (PBS) y azida de sodio al 0,02%. |
| Tubos de extracción | Para el uso de preparación de muestras. |
| Paquetes de hisopo | Para la colección de muestras. |
| Puesto de trabajo | Coloque para sostener viales y tubos de búfer. |
| Inserto de paquete | Para la instrucción de operación. |
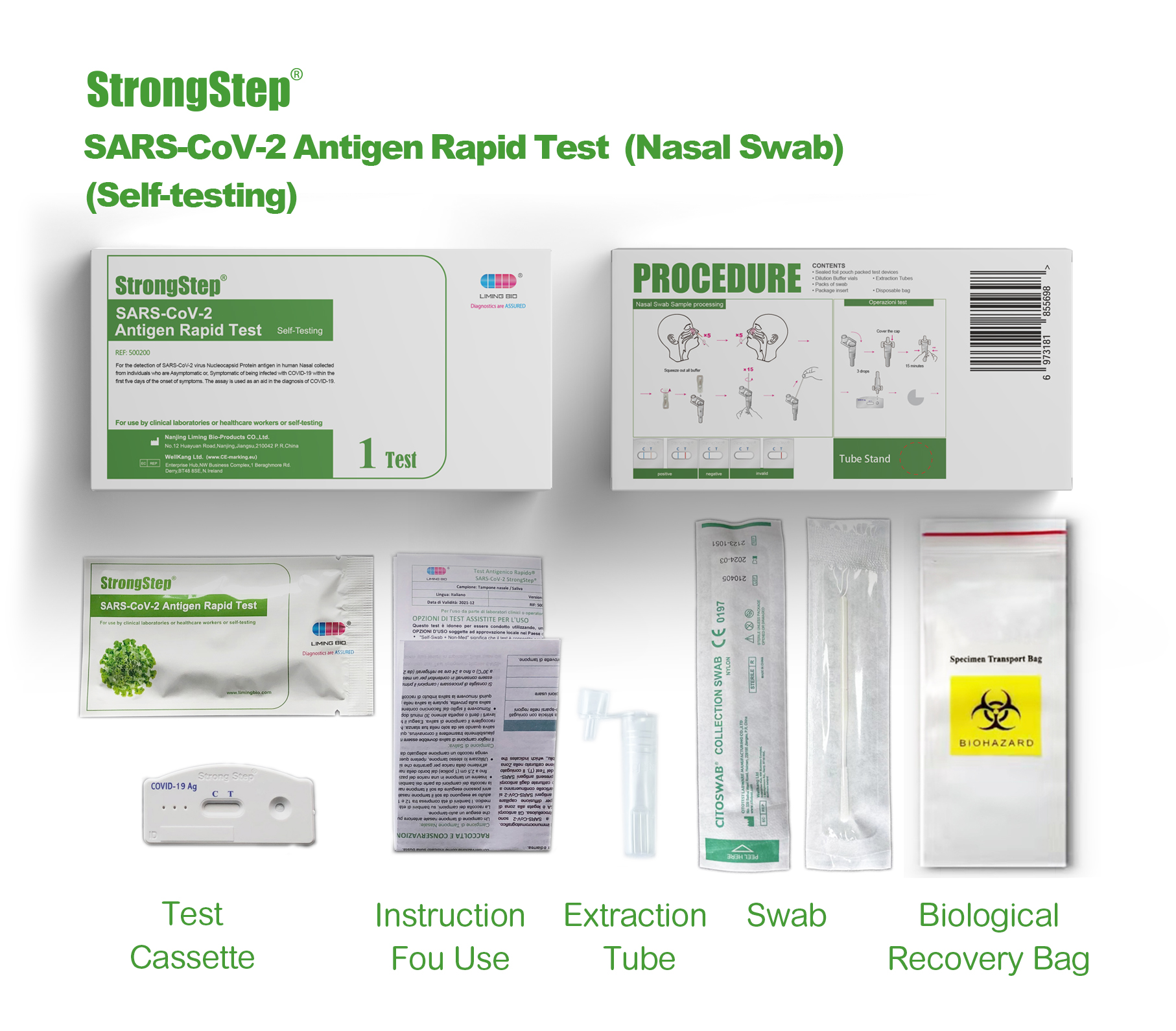
20 pruebas/caja
| 20 dispositivos de prueba empaquetados individualmente | Cada dispositivo contiene una tira con conjugados de colores y reactivos reactivos previamente en los reqions correspondientes. |
| 2 viales de tampón de extracción | 0,1 m de solución salina tamponada con fosfato (P8S) y 0.02% de azida de sodio. |
| 20 tubos de extracción | Para el uso de preparación de muestras. |
| 1 estación de trabajo | Coloque para sostener viales y tubos de búfer. |
| 1 inserto de paquete | Para la instrucción de operación. |
Materiales requeridos pero no proporcionados
| Minutero | Para uso de tiempo. |
| Cualquier equipo de protección personal necesario |
PRECAUCIONES
-Este kit es solo para uso de diagnóstico in vitro.
- Lea las instrucciones cuidadosamente antes de realizar la prueba.
- Este producto no contiene ningún material fuente humano.
-No use el contenido del kit después de la fecha de vencimiento.
Use guantes durante todo el procedimiento.
Almacenamiento y estabilidad
Las bolsas selladas en el kit de prueba se pueden almacenar entre 2-30 ° C durante la duración de la vida útil como se indica en la bolsa.
Colección y almacenamiento de muestras
Se puede recolectar una muestra de hisopo nasal anterior o mediante un individuo perforado como una suela.
Los niños menores de 18 años deben ser realizados por su supervisión ADUK. Los adultos de 18 años o más pueden realizar el hisopo nasal anterior por sí mismos. Siga sus pautas locales para la recolección de muestras de niños.
, Inserte un hisque en una fosa nasal del paciente. La punta del hisopo debe insertarse hasta 2.5 cm (1 pulgada) desde el borde de la fosa nasal. Enrolle el hisopo 5 veces a lo largo de la mucosa dentro de la fosa nasal para asegurarse de que se recolecten tanto la moco como las células.
• Use el mismo hisopo, repita este proceso para la otra fosa nasal para garantizar que se recolecte una muestra adecuada de ambas cavidades nasales.
Se recomienda que las muestras seanprocesadoTan pronto como sea posible después de la recolección. Las muestras se pueden mantener en el contenedor uptol hora a temperatura de mamá (15 ° C a 30 "c), o hasta 24 horas cuando Rsfrigeratod (2 ° C a 8eC) antes del procesamiento.
PROCEDIMIENTO
Traiga dispositivos de prueba, muestras, tampón y/o controles a la temperatura ambiente (15-30 ° C) de uso.
♦Plac® El tubo de extracción de muestras recolectadas en el área designada de la estación de trabajo.
♦Exprima todo el tampón de dilución en el tubo de radión ext.
♦Coloque el espécimen de hisopo en el tubo. Mezcle vigorosamente la solución girando el hisopo con fuerza contra el costado del tubo durante menos 15 veces (mientras está sumergido). Los mejores resultados se obtienen cuando la muestra se mezcla enérgicamente en la solución.
♦Permita que el hisopo empape en el tampón de extracción durante un minuto antes del siguiente paso.
♦Exprima la mayor cantidad de líquido posible del hisopo pellizcando el lado del tubo de extracción flexible a medida que se retira el hisopo. Al menos 1/2ofttie Sample Buffer Solution debe permanecer en el tubo para que se produzca una migración capilar adecuada. Coloque la tapa en el tubo extraído.
♦Deseche el hisopo en un contenedor de desechos biohazartos adecuados.
♦Las muestras extraídas pueden retener a temperatura ambiente durante 30 minutos sin afectar el resultado de la prueba.
♦Retire el dispositivo de prueba THS de su bolsa sellada y colóquelo en una superficie de nivel decano. Etiquete el dispositivo con identificación de paciente o control. Para obtener un mejor resultado, el ensayo debe realizarse en 30 minutos.
♦Agregue 3 gotas (aproximadamente 100 PL) de la muestra extraída del tubo de extracción al pozo de la muestra redonda en el dispositivo de prueba.
Evite atrapar burbujas de aire en el pozo (s) de muestra y no deje caer ninguna solución en la ventana de observación. A medida que la prueba comienza a funcionar, verá que el color se mueve a través de la membrana.
♦VERVIA PARA LA BANDAS DE COLOREDA Aparece. El resultado debe ser leído por Visual a 15 minutas. No interprete el resultado después de 30 minutos.
•Coloque el tubo de ensayo que contiene el hisopo y el dispositivo de prueba usado en la bolsa de biohazard de theat -theat -theat -theat -theat -theat -biohazard y séltelo, y luego deséchelo en un contenedor de desechos de biozardio adecuado. Luego tira los artículos restantes
•LavarTus manos o desinfectante de manos de reavelación.
Descarte los tubos de extracción utilizados y los dispositivos de prueba en un contenedor de desechos biohazartos adecuados.
V2.0_00.png)
Limitaciones de la prueba
1- El kit está destinado a usar para la detección cualitativa de los antígenos SARS-CoV-2 de Nasal.
2. Esta prueba detecta SARS-CoV-2 viable (en vivo) y no viable. El rendimiento de la prueba depende de la cantidad de virus (antígeno) en la muestra y puede o no correlacionarse con los resultados del cultivo viral realizado en la misma muestra.
3. Puede ocurrir un resultado negativo de la pezada si el nivel de antígeno en una muestra está por debajo del límite de detección de la prueba o si la muestra fue recolectada o transportada de manera incorrecta.
4. El fracaso para seguir el procedimiento de prueba puede afectar negativamente el rendimiento de la prueba y/o invalidar el resultado de la prueba.
5. Los resultados de la prueba deben estar correlacionados con el historial clínico, los datos epidemiológicos y otros datos disponibles para el médico que evalúa al paciente.
6. Los resultados de las pruebas positivas no descarten coinfecciones con otros patógenos.
7. Los resultados de las pruebas negativas no tienen la intención de gobernar en otras infecciones virales o bacterianas no SARS.
8. Los resultados negativos de los pacientes con inicio de los síntomas más allá de los siete días, deben tratarse como presuntivos y confirmados con un ensayo molecular autorizado local de la FDA, si es necesario, para el tratamiento clínico, incluido el control de infecciones.
9. Las recomendaciones de estabilidad del espectáculo se basan en los datos de estabilidad de las pruebas y el rendimiento de la influenza pueden ser diferentes con SARS-CoV-2. Los usuarios deben probar muestras lo más rápido posible después de la recopilación de muestras.
10. La sensibilidad para el ensayo RT-PCR en el diagnóstico de CoVID-19 es solo del 50% -80% debido a la mala calidad de la muestra o el punto de tiempo de la enfermedad en la fase recuperada, etc. más bajo debido a su metodología.
11. En el para obtener suficiente virus, se sugiere usar dos o más hisopos para recolectar diferentes sitios de muestra y extraer todos los hisopos muestreados en el mismo tubo.
12. Los valores predictivos positivos y negativos dependen en gran medida de las tasas de prevalencia.
13. Los resultados de las pruebas positivas tienen más probabilidades de representar resultados falsos positivos durante los períodos de poca actividad SARS-CoV-2 cuando la prevalencia de la enfermedad es baja. Los resultados de las pruebas negativas es más probable cuando la prevalencia de la enfermedad causada por SARS-CoV-2 IS es alto.
14. Los anticuerpos monoclonales pueden no detectar, o detectar con menos sensibilidad, virus de influenza SARS-CoV-2 que han sufrido cambios de aminoácidos menores en la región del epítopo objetivo.
15. El rendimiento de esta prueba no se ha evaluado para su uso en pacientes sin signos y síntomas de infección respiratoria y performancia puede diferir en los individuos asintomáticos.
16. La cantidad de antígeno en una muestra puede disminuir a medida que aumenta la duración de la enfermedad. Las muestras recolectadas después del día 5 de enfermedad tienen más probabilidades de ser negativas en comparación con un ensayo RT-PCR.
17. Se ha demostrado que la sensibilidad de la prueba después de los primeros cinco días del inicio de los síntomas disminuye en comparación con un ensayo RT-PCR.
18. Se sugiere que use la prueba rápida de anticuerpo IgM/IgG SARSSTEP® SARS-CoV-2 (CAW 502090) para detectar el anticuerpo para aumentar la sensibilidad del diagnóstico de CoVID-19.
19. No se recomienda utilizar la muestra de Virus Transportation Medla (VTM) en esta prueba, si los clientes insisten en usar este tipo de muestra, los clientes deben validarse.
20. La prueba rápida de antígeno SARTSTEP® SARS-COV-2 fue validada con los hisopos proporcionados en el kit. El uso de hisopos alternativos puede dar lugar a resultados falsos.
21. Las pruebas frecuentes son necesarias para aumentar la sensibilidad del diagnóstico de CoVID-19.
22. No se caiga en la sensibilidad en comparación con el tipo salvaje con las siguientes variantes: VOC1 Kent, Reino Unido, B.1.1.7 y VOC2 Sudáfrica, B.1.351.
23 Mantente fuera del alcance de los niños.
24. Los resultados positivos indican que los antígenos virales se detectaron en la muestra tomada, por favor, se autónomo e informe a su médico de familia de inmediato.
1V2.0_01_副本.jpg)
Nanjing Liming Bio-Products Co., Ltd.
No. 12 Huayuan Road, Nanjing, Jiangsu, 210042 PR China.
Tel: +86 (25) 85288506
Fax: (0086) 25 85476387
Correo electrónico:sales@limingbio.com
Sitio web: www.limingbio.com
Technical support: poct_tech@limingbio.com
Envasado de productos






V2.01_00_副本.jpg)
1人份抗原卡实物图唾液版1_00_副本-300x216.png)