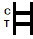Prueba rápida de fibronectina fetal
Uso de Ntended
El strongstep®La prueba PROM es una prueba inmunocromatográfica visualmente interpretada destinada a usarse para la detección cualitativa de fibronectina fetal en las secreciones cervicovaginales. La presencia de fibronectina fetal en las secreciones cervicovaginales entre 22 semanas, 0 días y 34 semanas, 6 días de gestación esasociado con un riesgo elevado de entrega prematuro.
Troducción
La entrega prematuro, definida por el Colegio Americano de Obstetras y Ginecólogos como entrega antes de la 37ª Semana de Gestación, es responsable de la mayoría de la morbilidad y mortalidad perinatal no cromosómicas. Los síntomas del parto prematuro amenazado incluyen contracciones uterinas, cambio de secreción vaginal, sangrado vaginal, dolor de espalda, incomodidad abdominal, presión pélvica y calambres. Las modalidades de diagnóstico para la identificación de la entrega prematuro amenazada incluyen el monitoreo de la actividad uterina y el rendimiento de un examen cervical digital, que permite la estimación de las dimensiones cervicales. Se ha demostrado que estos métodos son limitados, ya que la dilatación cervical mínima (<3 centímetros) y la actividad uterina ocurren normalmente y no son necesariamente diagnósticas de suministro premintero. Si bien se han evaluado varios marcadores bioquímicos séricos, ninguno ha sido ampliamente aceptado para uso clínico práctico.
La fibronectina fetal (FFN), una isoforma de fibronectina, es una glucoproteína adhesiva compleja con un peso molecular de aproximadamente 500,000 daltons. Matsuura y sus colaboradores han descrito un anticuerpo monoclonal llamado FDC-6, que reconoce específicamente III-CS, la región que define la isoforma fetal de la fibronectina. Los estudios inmunohistoquímicos de la placenta han demostrado que FFN esconfinado a la matriz extracelular de la región que define la uniónde las unidades maternas y fetales dentro del útero.
La fibronectina fetal se puede detectar en las secreciones cervicovaginales de las mujeres durante todo el embarazo mediante el uso de un inmunoensayo basado en anticuerpos monoclonales. La fibronectina fetal se eleva en las secreciones cervicovaginales durante el embarazo temprano, pero disminuye de 22 a 35 semanas en embarazos normales. No se entiende la importancia de su presencia en la vagina durante las primeras semanas del embarazo. Sin embargo, puede simplemente reflejar el crecimiento normal de la población de trofoblastos extravillas y la placenta. Detección de FFN en secreciones cervicovaginales entre 22 semanas, 0 días y 34 semanas, se informa que 6 días de gestación se asocia con el parto prematuro en sintomáticos y entre 22 semanas, 0 días y 30 semanas, 6 días en mujeres embarazadas asintomáticas.
PRINCIPIO
El strongstep®La prueba FFN utiliza la tecnología de flujo capilar de color inmunocromatográfico de color. El procedimiento de prueba requiere la solubilización de FFN de un hisopo vaginal mezclando el hisopo en el tampón de muestra. Luego, el búfer de muestra mixto se agrega bien a la muestra de casete de prueba y la mezcla migra a lo largo de la superficie de la membrana. Si FFN está presente en la muestra, formará un complejo con el anticuerpo anti-FFN primario conjugado con partículas de colores. El complejo estará unido por un segundo anticuerpo anti-FFN recubierto de la membrana de nitrocelulosa. La aparición de una línea de prueba visible junto con la línea de control indicará un resultado positivo.
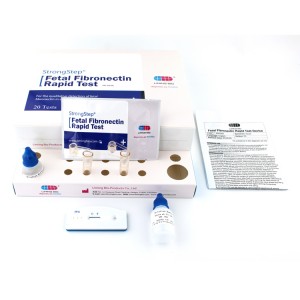
Componentes del kit
| 20 Individualmente PackDispositivos de prueba ED | Cada dispositivo contiene una tira con conjugados de color y reactivos reactivos previamente recubiertos en las regiones correspondientes. |
| 2ExtracciónVial búfer | 0,1 m de solución salina tamponada con fosfato (PBS) y azida de sodio al 0,02%. |
| 1 hisopo de control positivo (solo a pedido) | Contienen FFN y azida de sodio. Para control externo. |
| 1 hisopo de control negativo (solo a pedido) | No contener ffn. Para control externo. |
| 20 Tubos de extracción | Para el uso de preparación de muestras. |
| 1 Puesto de trabajo | Coloque para sostener viales y tubos de búfer. |
| 1 Inserto de paquete | Para la instrucción de operación. |
Materiales requeridos pero no proporcionados
| Minutero | Para uso de tiempo. |
PRECAUCIONES
■ Solo para uso de diagnóstico in vitro profesional.
■ No use después de la fecha de vencimiento indicada en el paquete. No use la prueba si su bolsa de lámina está dañada. No reutilice las pruebas.
■ Este kit contiene productos de origen animal. El conocimiento certificado del origen y/o el estado sanitario de los animales no garantiza totalmente la ausencia de agentes patógenos transmisibles. Por lo tanto, se recomienda que estos productos se traten como potencialmente infecciosos y se manejen observando las precauciones de seguridad habituales (no ingieran ni inhale).
■ Evite la contaminación cruzada de muestras mediante el uso de un nuevo contenedor de recolección de muestras para cada muestra obtenida.
■ Lea el procedimiento completo cuidadosamente antes de realizar cualquier prueba.
■ No coma, beba ni fume en el área donde se manejan las muestras y los kits. Manejar todas las muestras como si contengan agentes infecciosos. Observe las precauciones establecidas contra los riesgos microbiológicos a lo largo del procedimiento y siga los procedimientos estándar para la eliminación adecuada de las muestras. Use ropa protectora como capas de laboratorio, guantes desechables y protección para los ojos cuando se analizan las muestras.
■ No intercambie ni mezcle reactivos de diferentes lotes. No mezcle las tapas de las botellas de solución.
■ La humedad y la temperatura pueden afectar negativamente los resultados.
■ Cuando se complete el procedimiento de ensayo, deseche los hisopos cuidadosamente después de autoclárselo a 121 ° C durante al menos 20 minutos. Alternativamente, pueden tratarse con hipocloruro de sodio al 0,5% (o blanqueador de la casa) durante una hora antes de la eliminación. Los materiales de prueba utilizados deben descartarse de acuerdo con las regulaciones locales, estatales y/o federales.
■ No use cepillos de citología con pacientes embarazadas.
Almacenamiento y estabilidad
■ El kit debe almacenarse a 2-30 ° C hasta la fecha de vencimiento impresa en la bolsa sellada.
■ La prueba debe permanecer en la bolsa sellada hasta su uso.
■ No se congele.
■ Se deben tomar cuidado para proteger los componentes en este kit de la contaminación. No use si hay evidencia de contaminación microbiana o precipitación. La contaminación biológica de los equipos, contenedores o reactivos de dispensación puede conducir a falsos resultados.
Colección y almacenamiento de Pecímén
■ Use solo hisopos estériles con punta de dacron o rayón con ejes de plástico. Se recomienda utilizar el hisopo suministrado por el fabricante de kits (los hisopos no están contenidos en este kit, para la información de pedido, comuníquese con el fabricante o el distribuidor local, el número de catálogo es de 207000). Los hisopos de otros proveedores no han sido validados. No se recomiendan hisopos con puntas de algodón o ejes de madera.
■ Las secreciones cervicovaginales se obtienen del fórnix posterior de la vagina. El proceso de recolección está destinado a ser gentil. No se requiere una colección vigorosa o contundente, común para cultivos microbiológicos. Durante un examen de especulo, antes de cualquier examen o manipulación del cuello uterino o del tracto vaginal, gire ligeramente la punta del aplicador a través del fornix posterior de la vagina durante aproximadamente 10 segundos para absorber las secreciones cervicovaginales. Los intentos posteriores de saturar la punta del aplicador pueden invalidar la prueba. Retire el aplicador y realice la prueba como se indica a continuación.
■ Coloque el hisopo en el tubo de extracción, si la prueba se puede ejecutar de inmediato. Si no es posible las pruebas inmediatas, las muestras del paciente deben colocarse en un tubo de transporte seco para el almacenamiento o el transporte. Los hisopos se pueden almacenar durante 24 horas a temperatura ambiente (15-30 ° C) o 1 semana a 4 ° C o no más de 6 meses a -20 ° C. Se debe permitir que todas las muestras alcancen una temperatura ambiente de 15-30 ° C antes de la prueba.
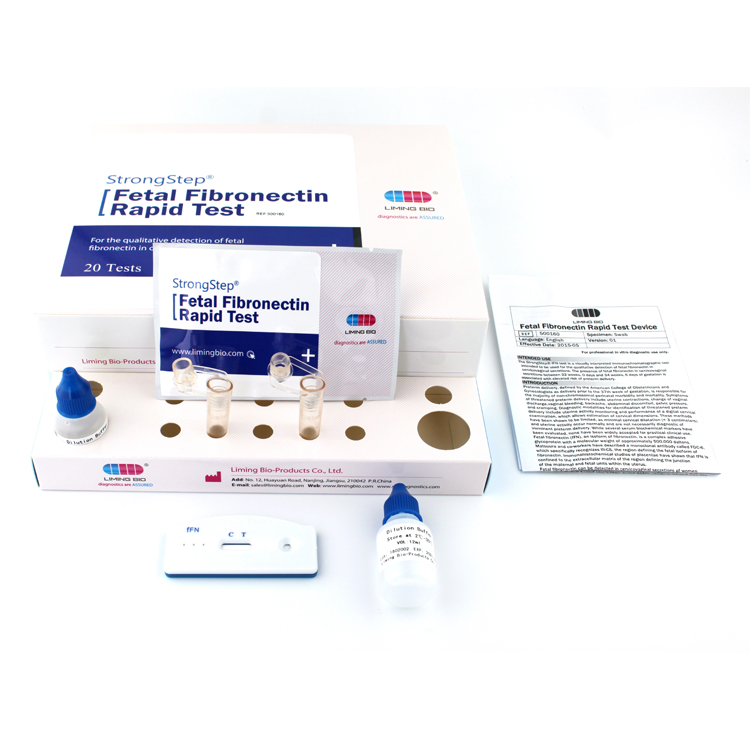
PROCEDIMIENTO
Traiga pruebas, muestras, tampón y/o controles a temperatura ambiente (15-30 ° C) antes de su uso.
■ Coloque un tubo de extracción limpio en el área designada de la estación de trabajo. Agregue 1 ml de tampón de extracción al tubo de extracción.
■ Coloque el espécimen de hisopo en el tubo. Mezcle vigorosamente la solución girando el hisopo con fuerza contra el costado del tubo durante menos diez veces (mientras está sumergido). Los mejores resultados se obtienen cuando la muestra se mezcla enérgicamente en la solución.
■ Exprima la mayor cantidad de líquido posible del hisopo pellizcando el lado del tubo de extracción flexible a medida que se retira el hisopo. Al menos 1/2 de la solución de tampón de muestra debe permanecer en el tubo para que se produzca una migración capilar adecuada. Coloque la tapa en el tubo extraído.
Deseche el hisopo en un contenedor de desechos biohazartos adecuados.
■ Las muestras extraídas pueden retener a temperatura ambiente durante 60 minutos sin afectar el resultado de la prueba.
■ Retire la prueba de su bolsa sellada y colóquela en una superficie limpia y nivelada. Etiquete el dispositivo con identificación de paciente o control. Para obtener un mejor resultado, el ensayo debe realizarse dentro de una hora.
■ Agregue 3 gotas (aproximadamente 100 µl) de la muestra extraída del tubo de extracción al pozo de muestra en el casete de prueba.
Evite atrapar burbujas de aire en el pozo (s) de muestra y no deje caer ninguna solución en la ventana de observación.
A medida que la prueba comienza a funcionar, verá que el color se mueve a través de la membrana.
■ Espere a que aparezcan las bandas de colores. El resultado debe leerse a los 5 minutos. No interprete el resultado después de 5 minutos.
Deseche los tubos de ensayo usados y los casetes de prueba en un contenedor de desechos biohazartos adecuados.
Nterpretación de resultados
| POSITIVORESULTADO:
| Aparecen dos bandas de colores en la membrana. Una banda aparece en la región de control (c) y otra banda aparece en la región de prueba (t). |
| NEGATIVORESULTADO:
| Solo aparece una banda de color en la región de control (C). No aparece ninguna banda de color aparente en la región de prueba (t). |
| INVÁLIDORESULTADO:
| La banda de control no aparece. Los resultados de cualquier prueba que no haya producido una banda de control en el tiempo de lectura especificado debe descartarse. Revise el procedimiento y repita con una nueva prueba. Si el problema persiste, suspenda con el kit de inmediato y comuníquese con su distribuidor local. |
NOTA:
1. La intensidad del color en la región de prueba (t) puede variar según la concentración de sustancias dirigidas presentes en la muestra. Pero el nivel de sustancias no se puede determinar mediante esta prueba cualitativa.
2. Volumen de muestra insuficiente, procedimiento de operación incorrecto o realización de pruebas caducadas son las razones más probables para la falla de la banda de control.
CONTROL DE CALIDAD
■ Los controles de procedimiento internos se incluyen en la prueba. Una banda de color que aparece en la región de control (c) se considera un control de procedimiento positivo interno. Confirma suficiente volumen de muestras y una técnica de procedimiento correcta.
■ Los controles de procedimiento externos pueden proporcionar (solo a pedido) en los kits para garantizar que las pruebas funcionen correctamente. Además, los controles pueden usarse para demostrar el rendimiento adecuado por parte del operador de prueba. Para realizar una prueba de control positiva o negativa, complete los pasos en la sección del procedimiento de prueba tratando el hisopo de control de la misma manera que un hisopo de muestras.
Limitaciones de la prueba
1. Este ensayo solo se puede utilizar para la detección cualitativa de fibronectina fetal en secreciones cervicovaginales.
2. Los resultados de las pruebas siempre deben usarse junto con otros datos clínicos y de laboratorio para el manejo del paciente.
3. Se deben obtener muestras antes del examen digital o la manipulación del cuello uterino. Las manipulaciones del cuello uterino pueden conducir a resultados falsos positivos.
4. Las muestras no deben recolectarse si el paciente ha tenido relaciones sexuales dentro de las 24 horas para eliminar los resultados falsos positivos.
5. Los pacientes con desprendimiento placentario sospechoso o conocido, la placenta previa o el sangrado vaginal moderado o bruto no deben ser probados.
6. Los pacientes con ceblaje no deben ser evaluados.
7. Las características de rendimiento del strongstep®La prueba FFN se basa en estudios en mujeres con gestaciones singleton. El rendimiento no se ha verificado en pacientes con múltiples gestaciones, por ejemplo, gemelos.
8. El fuerte®La prueba FFN no está destinada a realizarse en presencia de ruptura de membranas amnióticas y la ruptura de las membranas amnióticas debe descartarse antes de realizar la prueba.
Características de rendimiento
Tabla: prueba StrongStep® FFN vs. Otra prueba de FFN de marca
| Sensibilidad relativa: 97.96%(89.13%-99.95%)* Especificidad relativa: 98.73%(95.50%-99.85%)* Acuerdo general: 98.55%(95.82%-99.70%)* *Intervalo de confianza del 95% |
| Otra marca |
| ||
| + | - | Total | |||
| Fuerte®FFn Prueba | + | 48 | 2 | 50 | |
| - | 1 | 156 | 157 | ||
|
| 49 | 158 | 207 | ||
Sensibilidad analítica
La cantidad detectable más baja de FFN en la muestra extraída es de 50 μg/L.
Entre las mujeres sintomáticas, niveles elevados (≥ 0.050 μg/ml) (1 x 10-7 mmol/L) de FFN entre 24 semanas, 0 días y 34 semanas, 6 días indican un mayor riesgo de parto en ≤ 7 o ≤ 14 días a partir de desde entonces desde entonces desde Colección de muestras. Entre las mujeres asintomáticas, los niveles elevados de FFN entre 22 semanas, 0 días y 30 semanas, 6 días indican un mayor riesgo de entrega en ≤ 34 semanas, 6 días de gestación. El límite de 50 μg/L FFN se estableció en un estudio multicéntrico realizado para evaluar la asociación entre la expresión de fibronectina fetal durante el embarazo y el parto prematuro.
Sustancias interferentes
Se debe tener cuidado para no contaminar el aplicador o las secreciones cervicovaginales con lubricantes, jabones, desinfectantes o cremas. Los lubricantes o cremas pueden interferir físicamente con la absorción de la muestra en el aplicador. Los jabones o desinfectantes pueden interferir con la reacción de anticuerpo-antígeno.
Las sustancias interferentes potenciales se probaron en concentraciones que podrían encontrarse razonablemente en las secreciones cervicovaginales. Las siguientes sustancias no interfirieron en el ensayo cuando se probaron en los niveles indicados.
| Sustancia | Concentración | Sustancia | Concentración |
| Ampicilina | 1.47 mg/ml | Prostaglandina F2 | a0.033 mg/ml |
| Eritromicina | 0.272 mg/ml | Prostaglandina E2 | 0.033 mg/ml |
| Orina materna 3er trimestre | 5% (vol) | Monistatr (Miconazol) | 0.5 mg/ml |
| Oxitocina | 10 iu/ml | Carmín índigo | 0.232 mg/ml |
| Terbutalino | 3.59 mg/ml | Gentamicina | 0.849 mg/ml |
| Dexametasona | 2.50 mg/ml | Gel betadiner | 10 mg/ml |
| Mgso4•7H2O | 1.49 mg/ml | Betadiner limpiador | 10 mg/ml |
| Ritodrino | 0.33 mg/ml | Gelatina de K-años | 62.5 mg/ml |
| Dermicidolr 2000 | 25.73 mg/ml |
Referencias de literatura
1. Colegio Americano de Obstetras y Ginecólogos. Trabajo prematuro. Boletín técnico, número 133, octubre de 1989.
2. Creasy RK, Resnick R. Medicina materna y fetal: principios y práctica. Filadelfia: WB Saunders; 1989.
3. Creasy RK, Merkatz Ir. Prevención del parto prematuro: opinión clínica. Obstet Gynecol 1990; 76 (Supl. 1): 2s - 4s.
4. Morrison JC. Nacimiento prematuro: un rompecabezas que vale la pena resolver. Obstet Gynecol 1990; 76 (Supl. 1): 5s-12.
5. Lockwood CJ, Senyei AE, Dische MR, Casal DC, et al. Fibronectina fetal en secreciones cervicales y vaginales como predictor de suministro prematuro. New Engl J Med 1991; 325: 669–74.
Glosario de símbolos
|
| Número de catálogo |  | Limitación de temperatura |
 | Consulte las instrucciones para su uso |
| Código por lotes |
 | Dispositivo médico de diagnóstico in vitro |  | Usar |
 | Fabricante |  | Contiene suficiente para |
 | No reutilice |  | Representante autorizado en la comunidad europea |
 | CE marcado de acuerdo con la Directiva de dispositivos médicos IVD 98/79/CE | ||
Liming Bio-Products Co., Ltd.
No. 12 Huayuan Road, Nanjing, Jiangsu, 210042 PR China.
Tel: (0086) 25 85476723 Fax: (0086) 25 85476387
Correo electrónico:sales@limingbio.com
Sitio web: www.limingbio.com
www.stddiagnostics.com
www.stidiagnostics.com
Wellkang Ltd. (www.ce-marking.eu) Tel: +44 (20) 79934346
29 Harley St., London Wig 9qr, Reino Unido Fax: +44 (20) 76811874
Dispositivo de prueba rápido de fibronectina fetal StrongStep®

La entrega prematuro, definida por el Colegio Americano de Obstetras y Ginecólogos como entrega antes de la 37ª Semana de Gestación, es responsable de la mayoría de la morbilidad y mortalidad perinatal no cromosómicas. Los síntomas del parto prematuro amenazado incluyen contracciones uterinas, cambio de secreción vaginal, sangrado vaginal, dolor de espalda, incomodidad abdominal, presión pélvica y calambres. Las modalidades de diagnóstico para la identificación de la entrega prematuro amenazada incluyen el monitoreo de la actividad uterina y el rendimiento de un examen cervical digital, que permite la estimación de las dimensiones cervicales.
La prueba rápida de fibronectina fetal StrongStep® es una prueba inmunocromatográfica visualmente interpretada destinada a usarse para la detección cualitativa de fibronectina fetal en las secreciones cervicovaginales con las siguientes características:
Fácil de usar:Procedimiento de un solo paso en pruebas cualitativas
Rápido:Solo se requieren 10 minutos durante el mismo paciente visitando
Sin equipo:Los hospitales o el entorno clínico que limita la fuente puede realizar esta prueba
Entregado:temperatura ambiente (2 ℃ -30 ℃)