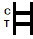Prueba rápida PROM
USO PREVISTO
El paso fuerte®La prueba PROM es una prueba inmunocromatográfica cualitativa interpretada visualmente para la detección de IGFBP-1 del líquido amniótico en las secreciones vaginales durante el embarazo.La prueba está diseñada para uso profesional para ayudar a diagnosticar la ruptura de las membranas fetales (ROM) en mujeres embarazadas.
INTRODUCCIÓN
La concentración de IGFBP-1 (proteína de unión al factor de crecimiento similar a la insulina-1) en el líquido amniótico es de 100 a 1000 veces mayor que en el suero materno.La IGFBP-1 no suele estar presente en la vagina, pero después de la ruptura de las membranas fetales, el líquido amniótico con una alta concentración de IGFBP-1 se mezcla con las secreciones vaginales.En la prueba StrongStep® PROM, se toma una muestra de secreción vaginal con un hisopo de poliéster estéril y se extrae la muestra en la solución de extracción de muestras.La presencia de IGFBP-1 en la solución se detecta utilizando un dispositivo de prueba rápida.
PRINCIPIO
El paso fuerte®La prueba PROM utiliza tecnología de flujo capilar inmunocromatográfica en color.El procedimiento de prueba requiere la solubilización de IGFBP-1 de un hisopo vaginal mezclando el hisopo en el tampón de muestra.Luego, el tampón de muestra mixto se agrega al pozo de muestra del casete de prueba y la mezcla migra a lo largo de la superficie de la membrana.Si IGFBP-1 está presente en la muestra, formará un complejo con el anticuerpo primario anti-IGFBP-1 conjugado con partículas coloreadas.Luego, el complejo se unirá a un segundo anticuerpo anti-IGFBP-1 que recubre la membrana de nitrocelulosa.La aparición de una línea de prueba visible junto con la línea de control indicará un resultado positivo.
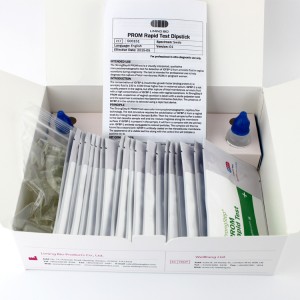
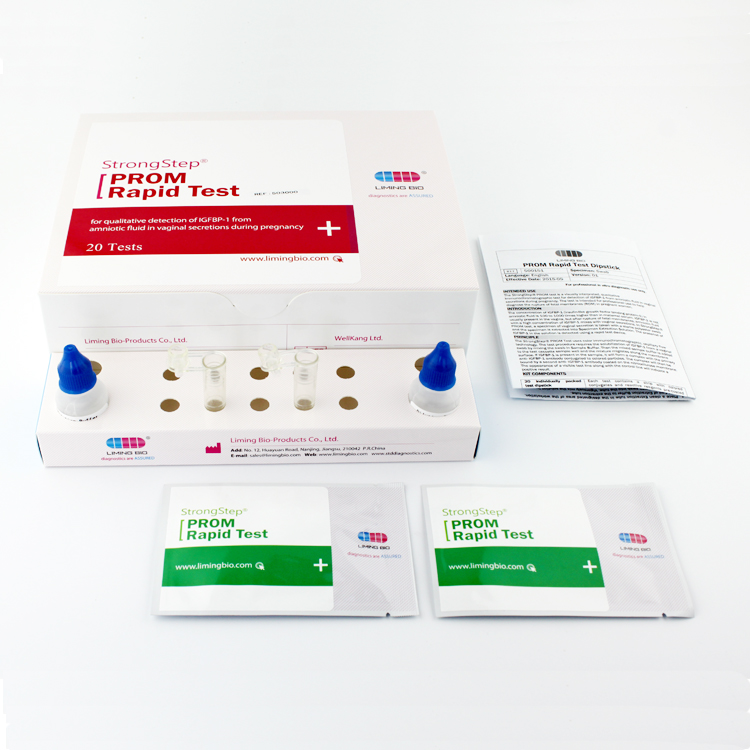
COMPONENTES DEL EQUIPO
| 20 individualmente preconocerdispositivos de prueba ed | Cada dispositivo contiene una tira con conjugados coloreados y reactivos pre-recubiertos en las regiones correspondientes. |
| 2ExtracciónVial de tampón | Solución salina tamponada con fosfato 0,1 M (PBS) y azida sódica al 0,02 %. |
| 1 hisopo de control positivo (solo bajo pedido) | Contiene IGFBP-1 y azida de sodio.Para control externo. |
| 1 hisopo de control negativo (solo bajo pedido) | No contiene IGFBP-1.Para control externo. |
| 20 Tubos de extracción | Para uso en preparación de especímenes. |
| 1 Puesto de trabajo | Lugar para guardar viales y tubos de tampón. |
| 1 Insertar paquete | Para instrucciones de operación. |
MATERIALES REQUERIDOS PERO NO SUMINISTRADOS
| Temporizador | Para uso de temporización. |
PRECAUCIONES
■ Sólo para uso profesional de diagnóstico in vitro.
■ No lo use después de la fecha de vencimiento indicada en el paquete.No use la prueba si su bolsa de aluminio está dañada.No reutilice las pruebas.
■ Este kit contiene productos de origen animal.El conocimiento certificado del origen y/o estado sanitario de los animales no garantiza totalmente la ausencia de agentes patógenos transmisibles.Por lo tanto, se recomienda que estos productos sean tratados como potencialmente infecciosos y manipulados con las precauciones de seguridad habituales (no ingerir ni inhalar).
■ Evite la contaminación cruzada de las muestras utilizando un recipiente de recogida de muestras nuevo para cada muestra obtenida.
■ Lea todo el procedimiento detenidamente antes de realizar cualquier prueba.
■ No coma, beba ni fume en el área donde se manipulan las muestras y los kits.Manipule todas las muestras como si contuvieran agentes infecciosos.Observe las precauciones establecidas contra los peligros microbiológicos durante todo el procedimiento y siga los procedimientos estándar para la eliminación adecuada de las muestras.Use ropa protectora como batas de laboratorio, guantes desechables y protección para los ojos cuando se analicen las muestras.
■ No intercambie ni mezcle reactivos de diferentes lotes.No mezcle las tapas de las botellas de solución.
■ La humedad y la temperatura pueden afectar negativamente los resultados.
■ Cuando finalice el procedimiento de ensayo, deseche los hisopos con cuidado después de esterilizarlos en autoclave a 121 °C durante al menos 20 minutos.Como alternativa, se pueden tratar con hipoclorito de sodio al 0,5 % (o lejía doméstica) durante una hora antes de desecharlos.Los materiales de prueba usados deben desecharse de acuerdo con las reglamentaciones locales, estatales y/o federales.
■ No utilice cepillos de citología con pacientes embarazadas.
ALMACENAMIENTO Y ESTABILIDAD
■ El kit debe almacenarse a 2-30 °C hasta la fecha de caducidad impresa en la bolsa sellada.
■ La prueba debe permanecer en la bolsa sellada hasta su uso.
■ No congelar.
■ Se deben tomar precauciones para proteger los componentes de este kit de la contaminación.No lo use si hay evidencia de contaminación microbiana o precipitación.La contaminación biológica de los equipos de dosificación, contenedores o reactivos puede dar lugar a resultados falsos.
RECOGIDA Y ALMACENAMIENTO DE MUESTRAS
Utilice únicamente hisopos estériles con punta de dacrón o rayón y mangos de plástico.Se recomienda utilizar el hisopo suministrado por el fabricante de los kits (los hisopos no están incluidos en este kit, para obtener información sobre pedidos, comuníquese con el fabricante o el distribuidor local, el número de catálogo es 207000).Los hisopos de otros proveedores no han sido validados.No se recomiendan hisopos con puntas de algodón o mangos de madera.
■ Se obtiene una muestra utilizando un hisopo de poliéster estéril.La muestra debe recolectarse antes de realizar un examen digital y/o una ecografía transvaginal.Tenga cuidado de no tocar nada con el hisopo antes de tomar la muestra.Inserte con cuidado la punta del hisopo en la vagina hacia el fórnix posterior hasta encontrar resistencia.Como alternativa, la muestra se puede tomar del fórnix posterior durante un examen con espéculo estéril.El hisopo debe dejarse en la vagina durante 10 a 15 segundos para permitir que absorba la secreción vaginal.¡Saque el hisopo con cuidado!.
■ Coloque el hisopo en el tubo de extracción, si la prueba se puede realizar de inmediato.Si no es posible realizar una prueba inmediata, las muestras de los pacientes deben colocarse en un tubo de transporte seco para su almacenamiento o transporte.Los hisopos se pueden almacenar durante 24 horas a temperatura ambiente (15-30°C) o 1 semana a 4°C o no más de 6 meses a -20°C.Se debe permitir que todos los especímenes alcancen una temperatura ambiente de 15-30°C antes de la prueba.
PROCEDIMIENTO
Lleve las pruebas, las muestras, el tampón y/o los controles a temperatura ambiente (15-30 °C) antes de su uso.
■ Coloque un tubo de extracción limpio en el área designada de la estación de trabajo.Agregue 1 ml de tampón de extracción al tubo de extracción.
■ Coloque el hisopo de la muestra en el tubo.Mezcle enérgicamente la solución girando el hisopo con fuerza contra el costado del tubo por lo menos diez veces (mientras está sumergido).Los mejores resultados se obtienen cuando la muestra se mezcla vigorosamente en la solución.
■ Exprima la mayor cantidad de líquido posible del hisopo apretando el costado del tubo flexible de extracción a medida que retira el hisopo.Al menos la mitad de la solución tampón de la muestra debe permanecer en el tubo para que se produzca una migración capilar adecuada.Coloque la tapa en el tubo extraído.
Deseche el hisopo en un contenedor adecuado para desechos biopeligrosos.
■ Las muestras extraídas pueden conservarse a temperatura ambiente durante 60 minutos sin afectar el resultado de la prueba.
■ Retire la prueba de su bolsa sellada y colóquela sobre una superficie limpia y nivelada.Etiquete el dispositivo con la identificación del paciente o del control.Para obtener el mejor resultado, el ensayo debe realizarse en el plazo de una hora.
■ Agregue 3 gotas (aproximadamente 100 µl) de muestra extraída del tubo de extracción al pozo de muestra en el casete de prueba.
Evite atrapar burbujas de aire en el pocillo de la muestra (S) y no deje caer ninguna solución en la ventana de observación.
A medida que la prueba comience a funcionar, verá que el color se mueve a través de la membrana.
■ Espere a que aparezcan las bandas de colores.El resultado debe leerse a los 5 minutos.No interprete el resultado después de 5 minutos.
Deseche los tubos de ensayo y los casetes de prueba usados en un contenedor adecuado para desechos biopeligrosos.
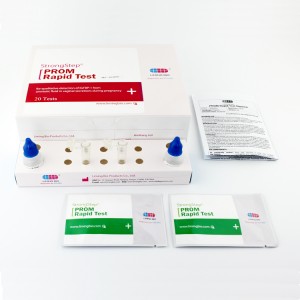
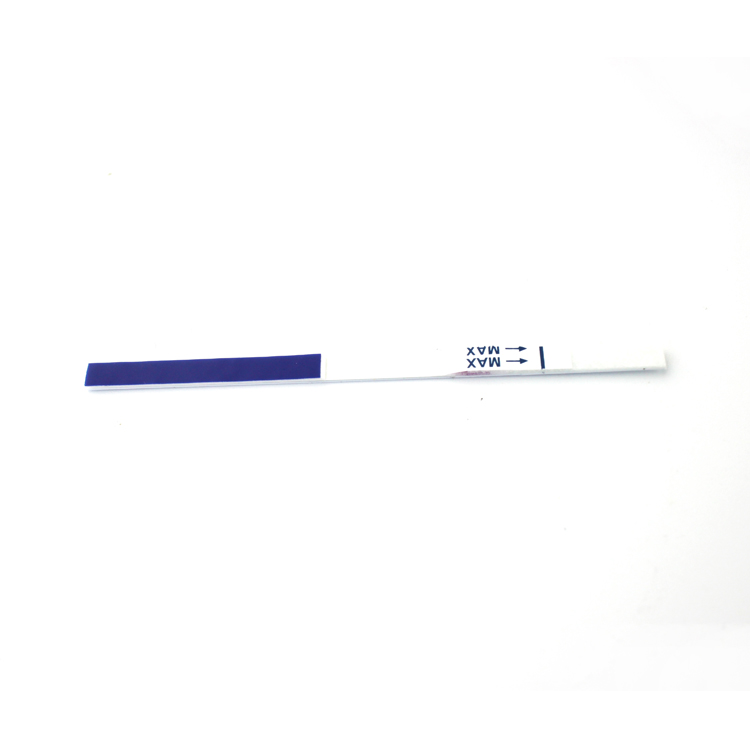
INTERPRETACIÓN DE RESULTADOS
| POSITIVORESULTADO:
| Aparecen dos bandas de colores en la membrana.Aparece una banda en la región de control (C) y aparece otra banda en la región de prueba (T). |
| NEGATIVORESULTADO:
| Solo aparece una banda de color en la región de control (C).No aparece ninguna banda de color aparente en la región de prueba (T). |
| INVÁLIDORESULTADO:
| La banda de control no aparece.Los resultados de cualquier prueba que no haya producido una banda de control en el tiempo de lectura especificado deben desecharse.Revise el procedimiento y repita con una nueva prueba.Si el problema persiste, deje de usar el kit inmediatamente y comuníquese con su distribuidor local. |
NOTA:
1. La intensidad del color en la región de prueba (T) puede variar según la concentración de las sustancias objetivo presentes en la muestra.Pero el nivel de sustancias no puede ser determinado por esta prueba cualitativa.
2. El volumen de muestra insuficiente, el procedimiento de operación incorrecto o la realización de pruebas caducadas son las razones más probables de la falla de la banda de control.
CONTROL DE CALIDAD
■ Los controles internos de procedimiento están incluidos en la prueba.Una banda de color que aparece en la región de control (C) se considera un control de procedimiento positivo interno.Confirma un volumen de muestra suficiente y una técnica de procedimiento correcta.
■ Se pueden proporcionar controles de procedimiento externos (solo a pedido) en los kits para garantizar que las pruebas funcionen correctamente.Además, los controles pueden usarse para demostrar el desempeño adecuado por parte del operador de la prueba.Para realizar una prueba de control positivo o negativo, complete los pasos de la sección Procedimiento de prueba tratando el hisopo de control de la misma manera que un hisopo de muestra.
LIMITACIONES DE LA PRUEBA
1. No se debe hacer ninguna interpretación cuantitativa basada en los resultados de la prueba.
2. No use la prueba si la bolsa de papel de aluminio o los sellos de la bolsa no están intactos.
3. Un paso fuerte positivo®El resultado de la prueba PROM, aunque detecta la presencia de líquido amniótico en la muestra, no localiza el sitio de la ruptura.
4. Al igual que con todas las pruebas de diagnóstico, los resultados deben interpretarse a la luz de otros hallazgos clínicos.
5. Si se ha producido la ruptura de las membranas fetales pero la fuga de líquido amniótico ha cesado más de 12 horas antes de que se tome la muestra, es posible que la IGFBP-1 haya sido degradada por las proteasas en la vagina y la prueba puede dar un resultado negativo.
CARACTERÍSTICAS DE PRESENTACIÓN
Tabla: paso fuerte®Prueba PROM vs. Prueba PROM de otra marca
|
Sensibilidad relativa: |
| otra marca |
| ||
| + | - | Total | |||
| paso fuerte®PASEO Prueba | + | 63 | 3 | 66 | |
| - | 2 | 138 | 140 | ||
|
| 65 | 141 | 206 | ||
Sensibilidad analítica
La cantidad más baja detectable de IGFBP-1 en la muestra extraída es de 12,5 μg/l.
Sustancias que interfieren
Se debe tener cuidado de no contaminar el aplicador o las secreciones cervicovaginales con lubricantes, jabones, desinfectantes o cremas.Los lubricantes o cremas pueden interferir físicamente con la absorción de la muestra en el aplicador.Los jabones o desinfectantes pueden interferir con la reacción antígeno-anticuerpo.
Las posibles sustancias que interfieren se probaron en concentraciones que podrían encontrarse razonablemente en las secreciones cervicovaginales.Las siguientes sustancias no interfirieron en el ensayo cuando se probaron en los niveles indicados.
| Sustancia | Concentración | Sustancia | Concentración |
| ampicilina | 1,47 mg/ml | Prostaglandina F2 | 0,033 mg/ml |
| Eritromicina | 0,272 mg/ml | Prostaglandina E2 | 0,033 mg/ml |
| Orina Materna 3er Trimestre | 5% (vol) | MonistatR (miconazol) | 0,5 mg/ml |
| oxitocina | 10 UI/mL | Índigo carmín | 0,232 mg/ml |
| terbutalina | 3,59 mg/ml | gentamicina | 0,849 mg/ml |
| Dexametasona | 2,50 mg/ml | Gel Betadine® | 10 mg/ml |
| MgSO4•7H2O | 1,49 mg/ml | Limpiador Betadine® | 10 mg/ml |
| ritodrina | 0,33 mg/ml | Jalea K-YR | 62,5 mg/ml |
| Dermicidol® 2000 | 25,73 mg/ml |
REFERENCIAS DE LITERATURA
Erdemoglu y Mungan T. Importancia de detectar la proteína 1 de unión al factor de crecimiento similar a la insulina en las secreciones cervicovaginales: comparación con la prueba de nitrazina y la evaluación del volumen de líquido amniótico.Acta Obstet Gynecol Scand (2004) 83:622-626.
Kubota T y Takeuchi H. Evaluación de la proteína 1 de unión al factor de crecimiento similar a la insulina como herramienta de diagnóstico para la ruptura de las membranas.J Obstet Gynecol Res (1998) 24:411-417.
RutanenEM et al.Evaluación de una tira de prueba rápida para la proteína de unión al factor de crecimiento similar a la insulina-1 en el diagnóstico de rotura de membranas fetales.Clin Chim Acta (1996) 253:91-101.
Rutanen EM, Pekonen F, Karkkainen T. Medición de la proteína 1 de unión al factor de crecimiento similar a la insulina en secreciones cervicales/vaginales: comparación con el inmunoensayo de membrana ROM-check en el diagnóstico de rotura de membranas fetales.Clin Chim Acta (1993) 214:73-81.
GLOSARIO DE SÍMBOLOS
|
| Numero de catalogo |  | Limitación de temperatura |
 | Consultar instrucciones de uso |
| Código de lote |
 | Dispositivo médico de diagnóstico in vitro |  | Usar por |
 | Fabricante |  | Contiene suficiente parapruebas |
 | no reutilizar |  | Representante autorizado en la Comunidad Europea |
 | Marcado CE de acuerdo con la Directiva de Dispositivos Médicos IVD 98/79/EC | ||